REACCIONES QUÍMICAS
1.
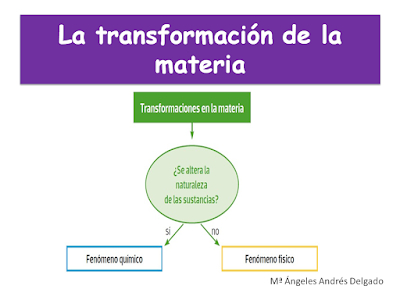
La transformación de la materia
|
Cambios físicos |
Cambios químicos |
|
No se produce ninguna modificación de
la naturaleza del sistema material. |
Se origina alguna modificación de la
naturaleza del sistema material. En un cambio químico, unas sustancias puras,
elementos químicos o compuestos químicos se transforman en otras diferentes. Para
ello tiene lugar una reordenación de los átomos de las distintas sustancias
puras que intervienen a través de una reacción química. |
|
Ejemplo: Congelación del agua |
Ejemplo: Oxidación del hierro |
2.
Mezcla o compuesto químico
|
Mezcla |
Compuesto químico |
|
Conserva las propiedades de sus
componentes. |
Sus propiedades son diferentes de las
de sus componentes iniciales. |
|
Los componentes se agrupan en
cualquier proporción. |
La proporción de sus componentes es
fija y determinada. |
|
No tiene una fórmula química. |
Tiene una fórmula química. |
|
La separación de los componentes se
realiza por procedimientos físicos, como la destilación, la decantación, la
atracción mediante un imán, etc. |
La separación de sus componentes se
realiza por un procedimiento químico a través de una reacción química. |
3.
Cantidad de sustancia
Cantidad de sustancia es una magnitud
proporcional a un número de partículas de dicha sustancia, que se utiliza como referencia,
que pueden ser, según sea el caso, átomos, moléculas, iones o electrones. Como
número de partículas de referencia se usa siempre 6,02·1023 que se
conoce como constante de Avogadro.
La constante de Avogadro, NA, es el factor de
conversión que permite dar el salto desde el nivel individual microscópico al
nivel macroscópico para un colectivo de partículas igual a 6,02·1023
La constante de Avogadro se puede
expresar en la unidad u/g, de forma que:
NA = 6,02·1023 u/g
La relación entre la unidad de masa
atómica, u, y la masa en gramos, g, es:
1 u = 1,6606·10-24 g
En el Sistema Internacional de unidades,
SI, la unidad de la magnitud cantidad de sustancia es el mol.
Mol de una
sustancia es la cantidad existente en un número de partículas de la misma igual
a la constante de Avogadro, NA NA = 6,02·1023 partículas/mol
= 6,02·1023 u/g
Si la masa de una sustancia se expresa
en g con el mismo valor numérico que tiene su masa en u, la cantidad de esa
sustancia es un mol.
Masa atómica
es la masa de un átomo de un elemento químico.
Masa molecular
es la masa de una molécula de una sustancia.
Ejemplo: masa molecular del agua.
El Agua, es H2O
La masa atómica
del H es 1 u y la del O es 16 u H2O: 2·1 u + 1·16 u = 18 u.
En el caso de una sustancia que no esté
representada por moléculas, como un sólido iónico, o un sólido covalente
reticular, no se puede emplear el término masa molecular y se debe usar el
concepto masa-fórmula.
Masa-fórmula
de una sustancia representada por su fórmula es igual a la suma de los
productos de las masas atómicas de los elementos químicos multiplicadas por los
subíndices de cada elemento químico en la fórmula.
Ejemplo: cloruro de sodio La masa atómica del Na es 23 u y la del Cl
es 35,5 u
La masa-fórmula del NaCl es:
M
= 1·23 u + 1·35,5 u = 58,5 u
En la comunidad científica de lengua
española no se suele diferenciar la masa-fórmula de la masa molecular, lo cual
es un error pues representan conceptos científicos distintos, algo que no se
hace en la lengua inglesa que distingue entre los conceptos de «formula mass» y «molecular mass» y no cometen el error de llamar masa molecular a
la masa-fórmula de un compuesto iónico como el NaCl.
Como lo que caracteriza a un compuesto
químico es su fórmula, se puede hallar la composición centesimal de los
elementos químicos del mismo, es decir, el tanto por ciento de la masa
correspondiente a cada uno de los elementos químicos que componen un compuesto
químico, de la forma:
%
de X= AX / M =100
n es el subíndice del elemento químico X de masa atómica AX en
la fórmula del compuesto químico, cuya masa-fórmula o molecular es M.
Masa molar, M, es la masa de un mol de una sustancia.
Se expresa en g/mol.
Ejemplo: Agua, H2O
La cantidad de sustancia, en mol, se
calcula dividiendo la masa m, dada en
g, de esa sustancia entre su masa molar M,
expresada en g/mol
En un mol hay un número de partículas igual a la constante de Avogadro NA = 6,02·1023 partículas/mol
4. La reacción química
H2 à O2 +H2 O
H2 +![]() O2 à H2 O
O2 à H2 O
1mol H 2 +![]() mol O2 à 1mol H 2O
mol O2 à 1mol H 2O
Reacción química: Transformación
de una o varias sustancias en otras diferentes.
Las sustancias que se transforman se
llaman reactivos, R, y las que se originan, productos de la reacción, P
reactivos → productos de la reacción
Ejemplo: oxidación del monóxido de
carbono
En el aire, el monóxido de carbono y el
oxígeno forman dióxido de carbono
monóxido de carbono (g) + dioxígeno (g) à dióxido de carbono (g)
CO + O2àCO2
En el lenguaje químico internacional la
expresión de una reacción química se llama ecuación química.
La ecuación
química muestra:
Los reactivos y los productos de la
reacción mediante sus respectivas fórmulas o símbolos químicos.
Los coeficientes
estequiométricos, que son unos números que proporcionan las cantidades
relativas de las sustancias que intervienen en la reacción química y que son
proporcionales al número de moléculas, átomos o iones de cada sustancia.
Ejemplo: oxidación del monóxido de carbono
En el aire, el monóxido de carbono y el
oxígeno forman dióxido de carbono
monóxido de carbono (g) + dioxígeno (g) àdióxido de carbono (g)
CO + O2àCO2
2CO + O2à2CO2
Una ecuación química representa los
cambios que tienen lugar en una reacción química y permite realizar el estudio
de la misma de una forma matemática, de modo que toda reacción química está
correctamente representada por su ecuación química si, y sólo si, se cumplen las
dos condiciones siguientes:
1.
Las
sustancias que intervienen en la reacción deben estar acertadamente descritas
por sus símbolos y fórmulas químicas.
2.
La
suma del número y tipo de átomos de los elementos químicos, que conforman los
reactivos, debe coincidir con la suma del número y tipo de átomos de los
elementos químicos en los productos de la reacción.
El ajuste
de la reacción consiste en determinar los valores numéricos de los
coeficientes estequiométricos de los reactivos y productos de reacción que intervienen
en una reacción química
Ley de Lavoisier o ley de conservación de la masa:
«En una reacción química, la masa total
de los reactivos transformados es igual a la masa total de los productos de la
reacción originados».
O también de otra forma: «Durante una
reacción química, la masa total de las sustancias que intervienen en la misma
permanece constante».
En una reacción química la materia ni se
crea ni se destruye, solo se reorganiza. Por tanto, en una reacción química, la
masa total de las sustancias puras que intervienen en la misma permanece
constante
Ley de Proust o ley de las proporciones definidas:
Cuando tiene lugar una reacción química
determinada, siempre se verifica está en una proporción fija y definida.
La ley de las proporciones definidas de
Proust muestra que los elementos químicos se combinan para formar compuestos
químicos, y siempre lo hacen en proporciones fijas y definidas
5. ¿Cómo se produce una reacción química?
Cada átomo, ion o molécula poseen una determinada energía propia o energía interna, U, por lo que en un sistema material que experimenta una reacción química, resulta que los reactivos tienen un contenido energético determinado, y los productos de la reacción, otro diferente, y la diferencia de energía interna, ΔU, entre los productos de reacción y los reactivos es igual a la energía intercambiada con su entorno o medio exterior:
ΔU = Uproductos - Ureactivos
Ejemplo: reacción química entre el
hidrógeno y el yodo
Ecuación química: H2 (g) + I2 (g) → HI (g) ;
Ajustada: H2 (g) + I2
(g) → 2 HI (g)
Rotura y formación de enlaces: H-H + I-I → 2 H-I
Ureactivos
Uproductos ![]() U → Uproductos -Ureactivos
U → Uproductos -Ureactivos
|
Reacción endoenergética El sistema capta energía del medio
exterior |
Reacción exoenergética El sistema transfiere energía al medio
exterior |
|
Uproductos |
Uproductos |
Energía de activación, Ea:
Energía mínima requerida para efectuar
una reacción química.
Es una barrera energética que hay que
vencer para que tenga lugar la reacción química.
Tiempo de reacción: tiempo en el que transcurre una reacción.
Velocidad de reacción: cantidad de una sustancia que se transforma en la unidad de tiempo en el
transcurso de la reacción química.
velocidad de la reacción = cantidad de sustancia transformada / tiempo
de reacción
|
Reacción química rápida |
Tiempo de reacción pequeño Velocidad de reacción elevada |
|
Reacción química lenta |
Tiempo de reacción elevado Velocidad de reacción pequeña |
6. Estequiometría de la reacción química
El número de partículas, N, de un reactivo o producto de reacción
se relaciona con la cantidad de sustancia, n,
en mol, a través de la ecuación:
N = n·NA donde NA es la
constante de Avogadro
7. Sustancias químicas de interés desde el punto de vista de las reacciones
químicas
Relación estequiométrica: Relación entre los coeficientes estequiométricos de la
ecuación química de la reacción química. Proporciona la estequiometría de la
ecuación química
Estequiometría: Cálculos
que se realizan sobre la ecuación química de una reacción química determinada
para hallar la masa de cualquiera de las sustancias que intervienen en la
reacción química, conocida la masa de otra, ya sea reactivo o producto de la
reacción.
Ácido: Sustancia que al disolverse en agua
proporciona hidrones, o iones H+
La forma más sencilla de escribir este
proceso es mediante la ecuación:
HA (aq) → H+ (aq) + A- (aq)
Base: Sustancia
capaz de aceptar hidrones, o iones H+
Ejemplo: transformación del amoníaco en
ión amonio NH3 + H+ →
NH4+
|
Ácidos |
Bases o álcalis |
|
Tienen sabor agrio |
Tienen sabor amargo |
|
Son corrosivos para la piel |
Son corrosivos para la piel |
|
En disolución conducen la corriente
eléctrica |
En disolución conducen la corriente
eléctrica |
|
Cambian el color de muchos colorantes
orgánicos y vegetales |
Modifican el color del colorante en
sentido opuesto al de los ácidos |
|
Reaccionan con numerosos metales,
desprendiendo gas hidrógeno |
Tienen un tacto untuoso y resbaladizo
para la piel |
|
Se neutralizan con las bases |
Se neutralizan con los ácidos |
|
La reacción entre una disolución
acuosa de un ácido y otra de una base se llama de neutralización y se forma
una sal más agua. |
|
Escala de pH
‒ Escala del 0 al 14
‒ El pH del agua pura es 7, que es el valor
neutro, ni ácido ni básico.
‒ Al añadir un ácido al agua disminuye el pH de
la disolución.
‒ Al añadir una base al agua aumenta el pH de la
disolución.
Indicador ácido-base
Sustancia que tiene una coloración
distinta según se encuentre en un medio ácido o básico, es decir, según sea el
pH.
El papel indicador universal es una
cinta de papel que adopta un color amarillo-rojizo en una disolución ácida y
verdoso-azulado si se moja con una disolución básica.
Existen muchas sustancias químicas, por
ejemplo los hidrocarburos, que al verificar las reacciones de combustión
liberan una gran cantidad de energía, generalmente en forma de calor.
Ejemplo:
combustión del metano metano (g) +
dioxígeno (g) →dióxido de carbono (g) + agua (g) + energía
CH4 + O2→CO2 + H2 O +890 kJ (sin ajustar)
CH4 + 2O2→CO2 + H2 O +890kJ
Fotosíntesis
Reacción que se produce en las plantas
verdes en presencia de la luz, y por la acción de la clorofila, para
transformar el dióxido de carbono que toman del aire y el agua que absorben del
suelo, en glucosa, un glúcido de fórmula C6H12O6,
rico en energía química.
La fotosíntesis se resume en la
siguiente ecuación química endoenergética:
dióxido de carbono + agua + energía → glucosa + oxígeno
CO2 + H O2 + energía →C H O6 12 6+ O2 (sin ajustar)
6+ CO2 + 6H O2 + energía →C H O6 12 6+ 6O2
Respiración celular
Proceso que ocurre en el interior de las
células de los organismos vivos en el que los nutrientes obtenidos a través de
los alimentos son procesados para extraer la energía química almacenada en
ellos, según la siguiente reacción exoenergética:
glucosa + oxígeno →dióxido de carbono + agua + energía
C H O6 12 6 + O2→CO2 + H O2 + energía (sin ajustar)
C H O6 12 6+ 6O2 →6CO2 + 6H O2+ energía
|
Reacciones bioquímicas aeróbicas |
Tienen lugar en presencia de oxígeno. Es el caso de la respiración celular y
ello hace que el ser humano realice ejercicios físicos aeróbicos que
necesitan de la respiración y como tales están: caminar, nadar, bailar,
esquiar o pedalear. |
|
Reacciones bioquímicas
anaeróbicas |
Tienen lugar en ausencia de oxígeno. Es el caso de la fermentación de la
glucosa y ello hace que las personas practiquen ejercicios físicos
anaeróbicos que comprenden la realización de actividades breves basadas en la
fuerza, tales como el esprintar o el levantamiento de pesas. |
Fermentación
Es un proceso biológico originado por
algunos microorganismos en ausencia del oxígeno del aire.
Por ejemplo, la fermentación de glúcidos
como la glucosa mediante levaduras origina el alcohol etanol, C2H5OH,
según la ecuación:
C6H O6→2C2H5OH+
2CO2
Putrefacción
Es un proceso de degradación de la
materia orgánica originado por microorganismos descomponedores, como bacterias
y hongos, que producen la descomposición de la materia orgánica con una
alteración de su aspecto, constitución y propiedades y la producción de olores
desagradables
Algunos ejemplos de química aplicada:
Fibras artificiales
Combustibles
Plásticos
Colorantes, tintes, cosméticos,
perfumes, jabones, detergentes, pinturas, barnices, lacas, disolventes
Aleaciones metálicas
Protección de metales frente a la
corrosión
Alimentación y nutrición
Agricultura
Siderurgia
Industria farmacéutica
Cuestiones sobre reacciones
químicas
Entra en joinmyquiz.com e introduce este
código 17450388.
Enlace URL: https://quizizz.com/join?gc=17450388


























































No hay comentarios:
Publicar un comentario