EL ÁTOMO
En 1808 John Dalton recupera la teoría atómica de Demócrito y considera que los átomos (partículas indivisibles) eran los constituyentes últimos de la materia que se combinaban para formar los compuestos.
En 1897 los experimentos realizados sobre la conducción de la electricidad por los gases dieron como resultado el descubrimiento de una nueva partícula con carga negativa: el electrón.
Los rayos catódicos estaban formados por
electrones que saltan de los átomos del gas que llena el tubo cuando es
sometido a descargas eléctricas. Los átomos, por tanto, no eran indivisibles.
J.J Thomson propone, entonces, el primer modelo de átomo compuesto:
“Los electrones (pequeñas partículas con carga
negativa) se encuentran incrustados en una nube con carga positiva.
La carga positiva de la nube compensa
exactamente la negativa de los electrones siendo el átomo eléctricamente
neutro.” Primer modelo de átomo compuesto (Thomson,
1897)
Modelo
de “pastel de pasas” Los electrones, diminutas partículas
con carga eléctrica negativa, están incrustadas en una nube de carga positiva
(azul) de forma similar a las pasas en un pastel.
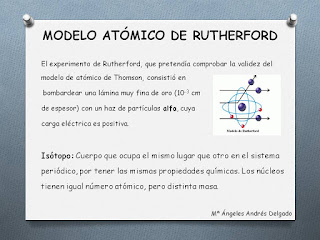
E. Rutherford propone un nuevo modelo de átomo, el llamado modelo planetario, en el que existe un núcleo muy pequeño, donde se localizan los protones y los neutrones, y los electrones orbitan en círculos alrededor del núcleo, de forma semejante a como lo hacen los planetas alrededor del Sol.
ESTRUCTURA DEL ÁTOMO
Núcleo del átomo.
Dimensiones muy reducidas comparadas con el tamaño
del átomo.
Partículas:
protones y neutrones (nucleones). Ambos tienen una masa considerable.
Un protón o un neutrón tiene una masa casi 2000 veces superior a la de un electrón.
Corteza del átomo
Los electrones orbitan en torno al núcleo.
Los electrones (carga - ) son atraídos
por el núcleo (carga + ).
El número de
electrones coincide con el de protones, por eso los átomos, en conjunto, no
tienen carga eléctrica.
Los átomos de elementos distintos se
diferencian en que tiene distinto número de protones en el núcleo (distinto Z).
Los átomos de un mismo elemento no son exactamente iguales, aunque todos poseen
el mismo número de protones en el núcleo (igual Z), pueden tener distinto
número de neutrones (distinto A).
El número de neutrones de un átomo se calcula así: n = A - Z
LA TABLA PERIÓDICA
La
tabla periódica de los elementos fue presentada por Mendeleiev en 1869
como una manera de clasificar los elementos conocidos. Permitía establecer
relaciones entre sus propiedades facilitando su estudio.
En
la tabla periódica los elementos se ordenan en filas o periodos que se numeran del 1 al 7, y en
columnas, grupos o familias, que
se numeran del 1 (alcalinos) al 18 (gases nobles).
El hidrógeno, el
elemento más ligero, tiene propiedades singulares y es difícil de ubicar, pero
se tiende a colocar en el grupo 1 (alcalinos), aunque sus propiedades son muy
distintas de los metales de este grupo y no se le considera un metal alcalino.
Todos los elementos de
un grupo tienen propiedades químicas semejantes.
Mendeleiev
(en 1869) ordenó los elementos de menor a mayor masa atómica, aunque en dos
ocasiones (Ar y K, Te y I) tuvo que invertir el orden para que los elementos se
situaran en el grupo que les correspondería por sus propiedades químicas. En
las tablas periódicas modernas los elementos se clasifican de menor a mayor número
atómico (número de protones).
El
número del periodo nos da el número total de capas u órbitas
de los átomos.
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
|
|
1 |
H
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He |
|
|
2 |
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Ne |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
La |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
Ac |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Grupo 1 Metales alcalinos(el H no pertenece a los alcalinos)
Grupo 2 Metales alcalinotérreos
Grupos 3 al 12 Elementos
de transición
Grupo 13 Grupo del boro
Grupo 14Grupo del carbono
Grupo 15Pnictógenos
Grupo 16Calcógenos
Grupo 17Halógenos
Grupo 18Gases nobles
Para cada elemento la
tabla periódica suministra abundante información.
Destacaremos como datos
importantes:
1.El símbolo y el
nombre.
2.El número atómico
(número de orden de la casilla).
3.La masa atómica (en
umas).
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
||
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
He |
||
|
2 |
Li |
Be |
|
|
|
|
|
|
|
|
|
|
B |
C |
N |
O |
F |
Ne |
||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Si |
|
|
Cl |
Ar |
||
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Ge |
As |
|
|
Kr |
||
|
5 |
|
|
La |
|
|
|
|
|
|
|
|
|
|
|
Sb |
Te |
|
Xe |
||
|
6 |
|
|
Ac |
|
|
|
|
|
|
|
|
|
|
|
|
Po |
At |
Rn |
||
|
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Una
línea quebrada separa, aproximadamente, los metales (que se sitúan a la
izquierda de la línea) y los no metales (a la derecha).
A
izquierda y derecha de la línea que divide metales y no metales se sitúan una
serie de elementos (trama oscura) que tienen propiedades de ambos, son los
llamados semimetales o metaloides.
Los
gases (trama vertical) se concentran a la derecha del S.P
Las propiedades químicas de los elementos están
íntimamente ligadas a la estructura electrónica de su última capa, llamada capa
de valencia.
Todos
los elementos de un mismo grupo tienen la misma estructura electrónica en su
última capa, esa es la razón de que tengan unas propiedades químicas similares.
Los gases nobles tienen una estructura electrónica
especialmente estable con ocho electrones en su última capa (excepto el He que
tiene dos).
Todos los
elementos tienden a adquirir la estructura de gas noble. Para eso tratan de captar o perder electrones
Los elementos (como los halógenos o calcógenos) a los que les faltan
solamente uno o dos electrones para adquirir la configuración de gas noble,
tienen mucha tendencia a captar electrones transformándose en iones con carga
negativa. Se dice que son muy electronegativos.
En general los no metales son elementos muy
electronegativos y tienden a captar electrones para dar iones negativos.
Los
no metales muestran energías de ionización elevadas, ya que si tienden a
captar electrones, mostrarán muy poca tendencia a cederlos. Por tanto, habrá
que comunicarles mucha energía para arrancárselos.
A
los elementos que están muy alejados de la configuración del gas noble
siguiente (como los metales alcalinos o alcalinotérreos), les resulta mucho más
sencillo perder uno o dos electrones para adquirir la configuración electrónica
del gas noble anterior. Por tanto, mostrarán mucha tendencia
a formar iones con carga positiva.
Se dice que son poco electronegativos.
En general, los metales son poco electronegativos y
tienden a perder electrones para dar iones positivos.
Los
metales tienen energías de ionización
bajas (cuesta muy poco arrancarles un electrón). La razón es sencilla:
si tienden a ceder electrones bastará con comunicarles muy poca energía para
arrancárselos
NOMBRES Y SÍMBOLOS DE
LOS ELEMENTOS QUE HAY QUE CONOCER
H: Hidrógeno
|
Alcalinos |
Alacalino térreos |
Metales transición |
Grupo del B |
Grupo del C |
Pnictógenos |
Calcóge nos |
Halóge nos |
Gases nobles |
|||||||||
|
Li |
Litio |
Be |
Berilio |
Cr |
Cro mo |
B |
Boro |
C |
Carbo no |
N |
Nitró geno |
O |
Oxígeno |
F |
Flúor |
He |
Helio |
|
Na |
So dio |
Mg |
Magne sio |
W |
Wol Fra mio |
Al |
Alu mi nio |
Si |
Silicio |
P |
Fósfo ro |
S |
Azu fre |
Cl |
Cloro |
Ne |
Neón |
|
K |
Potasio |
Ca |
Calcio |
Mn |
Man ga neso |
Ga |
Galio |
Ge |
Germa nio |
As |
Arsé nico |
Se |
Sele nio |
Br |
Bromo |
Ar |
Argón |
|
Rb |
Rubidio |
Sr |
Estron cio |
Fe |
Hie rro |
|
|
Sn |
Esta ño |
Sb |
Anti monio |
Te |
Telu ro |
I |
Yodo |
Kr |
Krip tón |
|
|
|
Ba |
Bario |
Co |
Co balto |
|
|
Pb |
Plomo |
|
|
|
|
|
|
Xe |
Xenón |
|
|
|
Ra |
Radio |
Ni |
Ní quel |
|
|
|
|
|
|
|
|
|
|
Rn |
Radón |
|
|
|
|
|
Pt |
Plati no |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cu |
Co bre |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ag |
Plata |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Au |
Oro |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Zn |
Cinc,zinc |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hg |
Mercurio |
|
|
|
|
|
|
|
|
|
|
|
|
Nomenclatura de las sustancias simples
Sustancias
simples son aquellas que están formadas por átomos idénticos.
De
manera general se nombran como el elemento químico correspondiente.
En
el caso de los no metales que forman sustancias moleculares, se nombran
indicando con un prefijo multiplicador el número de átomos que integran la
molécula. En algunos casos existen nombres vulgares (no sistemáticos) admitidos
(ver tabla).
|
Fórmula |
Nombre sistemático |
Nombre vulgar admitido |
|
Au |
oro |
|
|
Fe |
hierro |
|
|
H2 |
dihidrógeno |
|
|
N2 |
dinitrógeno |
|
|
O2 |
dioxígeno |
oxígeno |
|
O3 |
trioxígeno |
ozono |
|
S8 |
octaazufre |
|
Nomenclatura de iones monoatómico
Los
iones monoatómicos son átomos con carga.
Los
iones positivos (cationes) se nombran con el nombre del elemento químico
correspondiente y el número de carga entre paréntesis (no se deja espacio entre
el nombre y el paréntesis).




































No hay comentarios:
Publicar un comentario