1. Tipos de
reacciones químicas
REACCIONES QUÍMICAS DESDE EL PUNTO DE
VISTA ESTRUCTURAL
Síntesis: A + B
→ C Ejemplo:
oxidación del cobre 2 Cu + O2
→ 2 CuO Descomposición §
Descomposición
simple: A → B + C Ejemplo:
calcinación del carbonato de calcio
CaCO3 → CaO + CO2 §
Descomposición
mediante un reactivo: AB + C → AC + BC Ejemplo:
combustión de compuestos orgánicos, combustión del metano CH4 + 2 O2 → CO2 + 2 H2O Sustitución o desplazamiento: AB + C → AC + B Ejemplo:
reducción del óxido de cobre(II) con hidrógeno gas CuO + H2 → H2O + Cu Doble sustitución:
AB + CD → AC + BD Ejemplo: neutralización ácido-base, neutralización ácido
clorhídricohidróxido de sodio HCl + NaOH → NaCl + H2O Reacciones ácido-base:
Se transfieren cationes H+, hidrones, o iones hidrógeno
1+ Ejemplo: neutralización ácido-base, neutralización ácido
clorhídricohidróxido de sodio HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l) Reacciones de oxidación-reducción: Se transfieren electrones Ejemplo: reacción del sulfato de cobre(II) con el zinc CuSO4 (aq) + Zn (s) → ZnSO4 (aq) + Cu (s)
Se llama calor de
reacción, Qreacción, a la energía intercambiada en una reacción
química en forma de calor.
Si Qreacción <
0 la reacción es exotérmica
Se transfiere energía en forma de calor del sistema al
medio exterior.
Es el caso de la combustión del gas natural, donde el
calor transferido se puede aprovechar para cocinar los alimentos o para
calentar las viviendas. La combustión de la gasolina aprovecha los gases
expulsados y el calor transferido en la reacción química para poner en
movimiento un automóvil.
Si Qreacción >
0 la reacción es endotérmica
Se transfiere energía en forma de calor desde el medio
exterior al sistema.
Muchas descomposiciones de sustancias son
descomposiciones térmicas, como la del carbonato de calcio en óxido de calcio y
dióxido de carbono, donde la reacción química ocurre si existe el calentamiento
adecuado del sistema.
Reacciones
endoluminosas, que requieren el
aporte de energía luminosa o luz al sistema, como en el caso de la
fotosíntesis, que es el conjunto de reacciones químicas que ocurren en las
plantas verdes, a partir de la luz, el agua y el dióxido de carbono, y de esta
forma las plantas fabrican sus compuestos químicos orgánicos constituyentes,
como los glúcidos.
Reacciones
exoluminosas, en las que es el
sistema el que proporciona luz, como en el caso de la combustión del magnesio,
que además de originar óxido de magnesio proporciona una característica luz
blanca, que ha sido utilizada como flash en el campo de la fotografía.
Reacciones
endoeléctricas, como la
electrólisis, en la que se requiere el aporte de energía eléctrica para que
pueda tener lugar. Por electrólisis se puede descomponer agua en los gases
oxígeno e hidrógeno, y por electrólisis se obtiene en el mundo industrial el
metal aluminio.
Reacciones
exoeléctricas, que son aquellas
reacciones químicas en las que el sistema transfiere energía eléctrica al
exterior, como en el caso de las reacciones químicas que tienen lugar en las
pilas eléctricas.
2. La reacción de síntesis de formación del amoniaco
El amoniaco, NH3 , es una de las sustancias de
mayor importancia en el sector de la industria química, pues de él derivan una
amplia gama de productos químicos, entre los que se encuentran los abonos
destinados a la fertilización del suelo.
Obtención en
el laboratorio
Calentamiento del sulfato de amonio, (NH4)2SO4
, una sal del catión amonio,
NH4+ , en presencia de un hidróxido fuerte,
como el hidróxido de sodio, NaOH
(NH4)2SO4
(s) + 2 NaOH (aq) → 2 NH3 (g) + 2 H2O (l) + Na2SO4
(aq)
Obtención
industrial
Método Haber-Bosch
N2 (g) + 3 H2 (g) → 2 NH3 (g)
OBTENCIÓN DEL AMONIACO
Reacciones
químicas de descomposición
La calcinación es
un tratamiento térmico que se realiza en ausencia de aire y se aplica a
minerales y otros materiales sólidos para llevar a cabo una descomposición y,
generalmente, con la eliminación de un producto en forma de gas. El proceso se
lleva a cabo a una temperatura inferior a la de fusión del producto de reacción
sólido deseado.
Ejemplo:
calcinación de roca caliza para obtener cal
En un horno largo cilíndrico la roca caliza, que
mayoritariamente es carbonato de calcio, se calcina formando cal, u óxido de
calcio, y dióxido de carbono La ecuación química de la reacción que tiene lugar
es:
CaCO3 (s) → CaO
(s) + CO2 (g)
La tostación es
una reacción química de un sólido con un gas y que tiene lugar a una
temperatura elevada entre la atmósfera del horno en el que se efectúa la
reacción y el sólido objeto de la reacción.
Ejemplo:
tostación de la pirita para obtener hierro
En un horno de tostación de pirita, la pirita, o
disulfuro de hierro, reacciona con el oxígeno del aire para formar trióxido de
dihierro y dióxido de azufre.
La ecuación química de la reacción que tiene lugar es:
4 FeS2 (s) + 11 O2 (g) → 2 Fe2O3
(s) + 8 SO2 (g)
Reacciones
químicas de sustitución
En este tipo de reacción, uno o varios átomos de un
elemento químico que forman parte de un compuesto químico son reemplazados por
otro u otros átomos de otro elemento químico, según:
AB + C → AC + B
Mediante este tipo de reacción, los elementos químicos
más reactivos toman el puesto de los que son menos.
Ejemplos: 2 HCl (aq) + Mg
(s) → MgCl2 (aq) + H2 (g)
CuSO4
(aq) + Fe (s) → CuSO4 (aq) + Cu (s)
2 KBr (aq) + Cl2 (g)
→ 2 KCl (aq) + Br2 (l)
En este tipo de reacción ocurre un intercambio de átomos
o grupos de átomos de elementos químicos distintos entre las sustancias que
intervienen en la reacción química.
La reacción de doble sustitución se representa mediante: AB + CD → AC + BD
Ejemplos: AgNO3 (aq)
+ NaCl (aq) → AgCl (s) + NaNO3 (aq)
CaCO3 (s) + 2 HCl (aq) → CaCl2 (aq) + H2O
(l) + CO2 (g)
También pertenece a este tipo de reacciones químicas la
reacción química de neutralización entre un ácido y una base, como la
siguiente:
H2SO4
(aq) + 2 KOH (aq) → K2SO4 (aq) + 2 H2O
(l)
3. Reacciones
químicas de neutralización, hidrólisis y precipitación
La reacción
química entre un ácido y una base se llama reacción
de neutralización y en medio acuoso es una reacción de transferencia de
protones con la formación de sal más agua.
Ejemplo: 2 HCl (aq) + Ca(OH)2 (aq) → CaCl2
(aq) + 2 H2O (l)
Formalmente
dicha reacción química es una reacción de doble sustitución, pero lo que en
realidad ocurre en el agua son los siguientes procesos:
2 HCl → 2 Cl-
+ 2 H+
Ca(OH)2 →
2 OH- + Ca2+
De forma que
la verdadera reacción ácido-base es la formación de agua mediante la
transferencia de los iones H+ a los iones OH- según:
2 H+ + 2 OH- → 2 H2O
Y los iones Cl-
y Ca2+ no intervienen en el proceso, pues la sal cloruro de
calcio es iónica y en disolución lo que existe son dichos iones, es decir: CaCl2 → 2 Cl- + Ca2+
Reacción de
precipitación es aquella reacción
química en la que al mezclar dos reactivos en disolución se origina una
sustancia distinta sólida.
Ejemplo: Al añadir en un tubo de ensayo una disolución acuosa de
cloruro de sodio a otra disolución acuosa de nitrato de plata, se observa la
formación de un precipitado blanco. Este precipitado se vuelve más espeso y
desciende hasta el fondo del tubo de ensayo a medida que se añade más cantidad
de cloruro de sodio acuoso a la disolución de nitrato de plata.
Desde el punto de vista estructural lo que ocurre es la
siguiente reacción química de doble sustitución: NaCl
(aq) + AgNO3 (aq) → AgCl (s) + NaNO3 (aq)
Oxidación es un proceso de pérdida de electrones y reducción es el proceso inverso de
ganancia de electrones.
De esta definición se deduce que no puede haber procesos
de oxidación o de reducción aislados, porque si una especie química pierde
electrones, otra debe ganarlos y las reacciones de oxidación-reducción se
denominan generalmente de forma abreviada reacciones
redox.
Reductor es la especie química rica en electrones, que es capaz de
cederlos, y Oxidante es la especie
química pobre en electrones, que es capaz de aceptarlos.
En una reacción redox, el reductor cede electrones al
oxidante.
Toda oxidación va
unida necesariamente a una reducción,
y la reacción química que tiene lugar es una reacción de oxidación-reducción en la que hay transferencia de electrones desde
la sustancia que se oxida a la que se reduce.
Ejemplo: Formación del cloruro de calcio, que es un compuesto
iónico.
Ca + Cl2 → Ca2+ + 2 Cl-
El calcio se oxida
Ca → Ca2+ + 2 e
El cloro se reduce
Cl2 + 2 e- → 2 Cl-
Combustión o acción de quemar una sustancia.
Ejemplo:
Combustión del carbono del carbón en presencia del
oxígeno del aire, y mediante calor en la ignición:
C + O2 → CO2
Oxidaciones de
no metales y metales, empleando
diversos agentes oxidantes, como el oxígeno, O2, o el cloro, Cl2.
Ejemplo:
2 SO2 + O2 → 2 SO3 y Mg
+ Cl2 → MgCl2
Reducciones de
óxidos y sales metálicas
Ejemplo:
CuCl2 + H2 → Cu + 2 HCl
Son reacciones redox que ocurren en un medio húmedo o en
disolución acuosa.
Ejemplo: Cuando se introduce una chapa de cobre en una
disolución acuosa de nitrato de plata se observa que la disolución se vuelve de
color azul y se forma un depósito de color blanco sobre la chapa de cobre por
ocurrir en forma iónica la siguiente reacción de oxidación-reducción:
Cu
(s) + 2 Ag+ (aq) → Cu2+ (aq) + 2 Ag (s)
Un átomo de Cu se transforma en Cu2+ y los
electrones perdidos son tomados por dos iones de Ag+ para
convertirse en dos átomos de Ag. Oxidación: Cu → Cu2 + + 2 e -
Reducción: 2 Ag + + 2 e - → 2 Ag
7. Reacción química de combustión
Combustión: acción o efecto de quemarse algo.
Una combustión es una reacción química exotérmica que
tiene lugar habitualmente entre una sustancia con el oxígeno. Dicha reacción
química se manifiesta por una incandescencia o por la existencia de una llama.
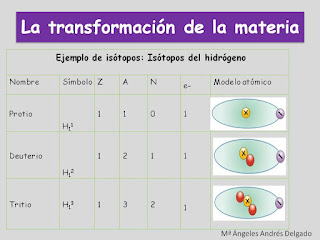
Isótopos:
Átomos del mismo elemento que tienen el mismo número de
protones y distinto número de neutrones.
|
Ejemplo de isótopos: Isótopos del
hidrógeno |
||||||
|
Nombre |
Símbolo |
Z |
A |
N |
e- |
Modelo atómico |
|
Protio
|
H11
|
1 |
1 |
0 |
1 |
|
|
Deuterio
|
H12 |
1 |
2 |
1 |
1 |
|
|
Tritio
|
H13 |
1 |
3 |
2 |
1 |
|
La radiactividad
natural es un fenómeno cuya actividad está ligada a la existencia de
núcleos de isótopos inestables de los átomos de algunos elementos químicos,
tales como el uranio o el radio, de manera que núcleos inestables de dichos
elementos químicos se desintegran o transforman en otros núcleos de otros
elementos químicos más estables y se emiten otras partículas, como las
partículas alfa, α, que hoy se sabe que son núcleos del isótopo de helio-4. Además, en el
proceso se transfiere al exterior una gran cantidad de energía.
Ejemplo: El núcleo del isótopo del radio de número másico 226 y
número atómico 88 se descompone en un isótopo de radón más otro núcleo de un
isótopo de helio-4: 22688Raà 22286Rn+ 42He
El núcleo del isótopo de radio se divide en dos
fragmentos, un núcleo de radón pesado y otro fragmento más pequeño, la
partícula alfa o isótopo de helio-4
Reacciones
nucleares: suceden al bombardear con
partículas los núcleos de algunos isótopos de átomos de diversos elementos
químicos.
En la ecuación de un proceso nuclear se conservan tanto
el número másico como el número atómico:
La suma de los números másicos de los reactivos es igual
a la suma de los números másicos de los productos que se obtienen.
La suma de los números atómicos de los reactivos es igual
a la suma de los números atómicos de los productos obtenidos.
Ejemplo: Al bombardear un núcleo de aluminio-27 con una
partícula alfa se obtienen un núcleo de fósforo-30 y un neutrón
2713 Al + 4 2He à 30 15P
+ 1 0 n
En una reacción
química intervienen los electrones de los átomos, mientras que en una
reacción nuclear participan los núcleos de los átomos.
En una reacción
nuclear se obtienen núcleos de elementos químicos diferentes de los
utilizados como reactivos, mientras que en una reacción química no puede haber
en los productos de la reacción elementos químicos que no estén antes en los
reactivos.
Una reacción de fisión
nuclear es aquella en la que un núcleo se rompe en otros fragmentos más
pequeños.
Ejemplo:
Fisión nuclear del uranio-235
235 92U + 1 0 n à 93 37Rb+14055 Cs +3
1 0 n
Una reacción de fusión
nuclear es aquella en la que dos núcleos de átomos ligeros se unen para
producir un núcleo mayor.
Ejemplo:
Fusión nuclear
del hidrógeno para dar helio
12 H +12 Hà 12He+ 1 0 n
Central
nuclear: instalación productora de
energía eléctrica a partir de la reacción en cadena de fisión de un combustible
nuclear.
9.
Contaminación radiactiva
La radiación es
una emisión que puede ser resultado de radiación
corpuscular o de radiación
electromagnética:
En la radiación
corpuscular se transmiten pequeñas partículas que se mueven a gran
velocidad y si son muy energéticas resultan ionizantes.
En la radiación
electromagnética la energía se propaga en forma de ondas electromagnéticas
a la velocidad de la luz, 300 000 km/s
La radiactividad es
un proceso de liberación de energía que va acompañado de la emisión de pequeñas
partículas, como las partículas alfa o los neutrones, que se mueven a gran
velocidad y que constituyen la llamada radiación corpuscular.
Si la energía liberada es elevada, se ioniza el medio
circundante y dicha radiación corpuscular muy energética es, además, ionizante pues en su interacción con la
materia arranca electrones y produce iones.
Se denomina contaminación
radiactiva la presencia no deseada de partículas radiactivas en el entorno,
que son perjudiciales para la salud y/o el medio ambiente
|
Naturales |
Derivan de procesos radiactivos de desintegración
espontáneos procedentes del cosmos y del Sol y la Tierra ocasionados por los
materiales del suelo, del aire o del agua. Unas emisiones son más o menos
constantes, como las procedentes del núcleo 1940K que se ingiere con los alimentos, pero otras son
variables, como los rayos cósmicos que son más intensos a mayor altitud.
|
|
Artificiales |
Derivan de procesos provocados mediante una reacción
nuclear en pruebas de armamento nuclear, exposiciones médicas con radiaciones
ionizantes, la radiactividad de las centrales nucleares, centros de
investigación física de altas energías, la minería del uranio, los usos
industriales de la radiación corpuscular y los accidentes ocurridos en el
transporte, manipulación y eliminación de desechos radiactivos.
|
|
De
alta actividad |
Son los que emiten altas dosis de
radiación y que suelen durar hasta miles de años. Están formados por los
restos de las varillas del uranio que se usa como combustible en las
centrales nucleares y de residuos de la fabricación de armas atómicas. |
|
De media o baja actividad |
Emiten cantidades pequeñas de
radiación. Están formados por herramientas, ropas o piezas de repuesto de
centrales nucleares, hospitales, organismos de investigación e industrias. |
La
10. Efectos positivos y negativos del uso de la energía
nuclear
|
Positivos |
Negativos |
|
Permite generar una cantidad inmensa
de energía eléctrica |
Su tecnología es compleja y está en
manos de pocos países |
|
Evita el vertido a la atmósfera de millones de
toneladas de CO2 |
Algunos países la usan para crear armas nucleares |
|
La medicina ha logrado grandes avances gracias a la
energía nuclear |
Cualquier escape radiactivo puede tener nefastas consecuencias |
|
La industria alimenticia consigue mejorar la
conservación de alimentos y el sector agrícola combate plagas |
Chernóbil y Fukushima son realmente paradigmáticas del riesgo que supone para la Humanidad |
















































No hay comentarios:
Publicar un comentario