En la antigua Grecia dos concepciones compitieron por dar una interpretación racional a cómo estaba formada la materia.
Demócrito consideraba que la materia
estaba formada por pequeñas partículas indivisibles, llamadas átomos, entre los
cuales existe vacío.
Aristóteles era partidario de la teoría
de los cuatro elementos, según la cual toda la materia estaría formada por la
combinación de cuatro elementos: aire, tierra, fuego y agua.
En 1808 John Dalton recupera la teoría
atómica de Demócrito y considera que los átomos (partículas indivisibles) eran
los constituyentes últimos de la materia que se combinaban para formar los
compuestos.
La teoría de los cuatro elementos fue la
aceptada durante muchos siglos.
Siguiendo la teoría aristotélica los
alquimistas (que están considerados como los primeros químicos) intentaban
obtener
Su incesante trabajo en el laboratorio
dio como fruto la invención o perfeccionamiento de muchos procedimientos aún
hoy usados en los laboratorios (entre ellos la destilación), la síntesis de
numerosos compuestos (como el ácido clorhídrico, sulfúrico o nítrico), el
descubrimiento de técnicas metalúrgicas, la producción de tintes, pinturas o
cosméticos… etc.
En 1897 los experimentos realizados
sobre la conducción de la electricidad por los gases dieron como resultado el
descubrimiento de una nueva partícula con carga negativa: el electrón.
Los rayos catódicos estaban formados por
electrones que saltan de los átomos del gas que llena el tubo cuando es
sometido a descargas eléctricas. Los átomos, por tanto, no eran indivisibles.
J.J Thomson propone, entonces, el primer
modelo de átomo compuesto:“Los electrones (pequeñas partículas con carga
negativa) se encuentran incrustados en una nube con carga positiva.
La carga positiva de la nube compensa
exactamente la negativa de los electrones siendo el átomo eléctricamente
neutro.” Primer modelo de átomo compuesto (Thomson,
1897)
J. J. Thomson (1856-1940)
Modelo
de “pastel de pasas” Los electrones, diminutas partículas
con carga eléctrica negativa, están incrustadas en una nube de carga positiva
(azul) de forma similar a las pasas en un pastel.
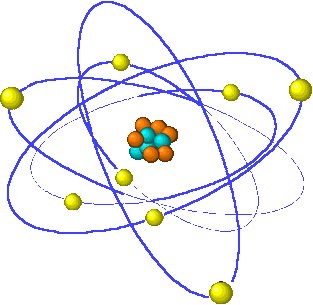
El modelo de átomo planetario
(Rutherford, 1911)
E. Rutherford propone un nuevo modelo de
átomo, el llamado modelo planetario, en el que existe un núcleo muy pequeño,
donde se localizan los protones y los
neutrones, y los electrones orbitan en círculos alrededor del núcleo, de forma semejante a como lo hacen los
planetas alrededor del Sol.
ESTRUCTURA DEL ÁTOMO
Núcleo del átomo.
Dimensiones muy reducidas comparadas con el tamaño
del átomo.
Partículas:
protones y neutrones (nucleones). Ambos tienen una masa considerable.
Un
protón o un neutrón tiene una masa casi 2000 veces superior a la de un
electrón.
Por
tanto la masa del átomo radica en el núcleo. Los protones tienen carga positiva
y los neutrones carecen de carga. El número total de nucleones viene dado por
el número másico, A. Los
nucleones están unidos muy fuertemente por la llamada “fuerza nuclear fuerte”. El número de protones del núcleo es lo que
distingue a un elemento de otro.
El número atómico, Z, nos da el
número de protones del átomo y coincide con el número de la casilla que el
elemento ocupa en la tabla periódica.
Corteza del átomo
Los electrones orbitan en torno al núcleo.
Los electrones (carga - ) son atraídos
por el núcleo (carga + ).
El número de
electrones coincide con el de protones, por eso los átomos, en conjunto, no
tienen carga eléctrica.
Los átomos de elementos distintos se diferencian en que tiene distinto número de protones en el núcleo (distinto Z). Los átomos de un mismo elemento no son exactamente iguales, aunque todos poseen el mismo número de protones en el núcleo (igual Z), pueden tener distinto número de neutrones (distinto A).
El número de neutrones de un átomo se
calcula así: n = A - Z
Los átomos de un mismo elemento (igual
Z) que difieren en el número de neutrones (distinto A), se denominan isótopos. Todos los isótopos tienen
las mismas propiedades químicas, solamente se diferencian en que unos son un
poco más pesados que otros. Algunos isótopos pueden desintegrarse
espontáneamente emitiendo energía. Son los llamados isótopos radiactivos.
¿QUÉ ES UN ION? ¿CÓMO SE FORMAN LOS IONES?
Si
a un electrón se le comunica suficiente energía, puede “saltar” del átomo
venciendo la fuerza de atracción que lo une al núcleo. Esto es tanto más fácil
cuanto más alejado se encuentre del núcleo.
Al
quitar un electrón el átomo quedará con carga
(+), ya que habrá un electrón menos (una carga negativa menos) y los
mismos protones (cargas positivas) en el núcleo. El átomo ya no sería
eléctricamente neutro, tiene carga. Se convierte en un
ion.
El proceso de obtener iones con carga
(+), o cationes, no puede hacerse añadiendo protones en el núcleo. Si hiciéramos esto alteraríamos el número
atómico del elemento (Z) y se produciría la transmutación del elemento en otro
con número atómico superior.
En determinadas condiciones un átomo puede captar un electrón. Sucede entonces que, al haber un electrón de más, el átomo queda cargado negativamente. Obtenemos un ion negativo o anión.
Ejemplos:
Iones positivos (cationes) Li +, Al3+, Fe2+
Iones positivos (aniones) O2-, Cl –, N3-
Si
al isótopo más abundante del hidrógeno se le arranca su único electrón lo que
queda es un protón: H – e à H+
De aquí que una de las formas de referirnos al protón sea como H+
Si al átomo de He se le arrancan sus dos electrones obtenemos un núcleo de He con carga 2+. Es lo que se llama una “partícula alfa” He – 2 e à He2+
Estructura
de la corteza
Para “construir” la corteza (o envoltura
electrónica) de un átomo, averigua cuántos electrones tiene (si es un átomo
neutro: nº de electrones = Z) y vete rellenando las capas, empezando por la
primera, y teniendo en cuenta el número máximo de
electrones que puede haber en cada capa.
Primera capa Nº
máximo de electrones= 2
Segunda
capa Nº máximo de electrones= 8
Tercera
capa. Tiene solamente un electrón.
La
última capa, o capa más externa, recibe el nombre de “capa de valencia” y
los electrones situados en ella “electrones de valencia”.
En este átomo la capa de valencia es la
tercera y tiene un único electrón de valencia.
MASA DE LOS ÁTOMOS
Los átomos son extraordinariamente
pequeños y su masa, en consecuencia, pequeñísima, tanto que si usamos como
unidad para medirla las unidades de masa a las que estamos acostumbrados,
obtendríamos valores muy pequeños, difícilmente manejables.
Por ejemplo, el átomo de hidrógeno tiene
una masa de 1,66 .10 –27 kg y el de carbono 2,00. 10– 26
kg
Por
esta razón para medir la masa de los átomos se adopta una nueva unidad: la unidad de masa atómica (u.m.a). La
u.m.a se define de la siguiente manera:
Consideremos un átomo del isótopo más
abundante de C, el 12 C; lo
dividimos en doce partes iguales y tomamos una de ellas. La masa de esta parte
sería la unidad de masa atómica (u. m .a).
Se define la unidad de masa atómica como
la doceava parte de la masa del átomo de 12C
Considerando esta nueva unidad el 12C
tiene una masa de 12 u.
Imaginemos una balanza capaz de pesar átomos (es una ficción, no es real). Si quisiéramos determinar la masa de un átomo de oxígeno, lo pondríamos en un platillo e iríamos añadiendo unidades de masa atómica al otro. Cuando se equilibrara la balanza, solo tendríamos que contar cuantas umas hemos colocado en el otro platillo y tendríamos la masa del átomo de oxígeno en umas.
La masa atómica del protón y del neutrón
es muy aproximadamente 1 uma, mientras
que la masa del electrón es notablemente más baja (aproximadamente 1830 veces
más pequeña que la masa del protón).
NOMENCLATURA DE COMPUESTOS BINARIOS
Los compuestos binarios están formados
por la combinación de dos elementos.
Si el oxígeno no forma parte del
compuesto, los compuestos binarios se nombran citando los elementos que lo
forman e indicando con prefijos multiplicadores la proporción en la que se
combinan:
Si nos dan el nombre de un compuesto
podemos escribir la fórmula que le corresponde siguiendo las siguientes normas:
1. Se
escribe a la derecha el símbolo del elemento que acaba en uro, afectado de un
subíndice que nos viene indicado por el prefijo multiplicador que lleve en el
nombre. Si el prefijo es mono-, de forma general, se suprime.
2. Se
escribe a la izquierda el símbolo del elemento que no acaba en uro, afectado
del subíndice que indique el prefijo multiplicador del nombre
IMPORTANTE
1. Al2S3 trisulfuro de dialuminio
Si el prefijo es mono-,
de forma general, se suprime.
El símbolo del elemento terminado en uro se escribe a la derecha
Subíndice indicado por el prefijo del nombre (3)
El símbolo de elemento citado en segundo lugar (y que no acaba en uro) se escribe a la izquierda
2. CoH2
dihidruro de cobalto
El símbolo del elemento citado en
segundo lugar se escribe a la izquierda.
En el nombre no figura prefijo
multiplicador para el cobalto. En este caso se sobreentiende que es mono- (se ha suprimido). El “1”, tampoco
se pone como subíndice.
El símbolo del hidrógeno se escribe a la
derecha.
Subíndice indicado por el prefijo (2).
Subíndice indicado por el prefijo del nombre (2).
3. LiH hidruro de litio
El símbolo del hidrógeno se escribe a la
derecha
Subíndice 1 (no se pone), ya que no hay
prefijo.
El símbolo del elemento citado en
segundo se escribe a la izquierda.
Subíndice del litio (1), no se pone
4. FeCl3 tricloruro de hierro
El símbolo del cloro se escribe a la
derecha
Subíndice indicado por el prefijo (3).
El símbolo del elemento citado en
segundo lugar se escribe a la izquierda.
Subíndice del hierro (1), no se pone
5.
N2O5
pentaóxido de
dinitrógeno
El oxígeno se escribe a la derecha Subíndice indicado por el prefijo (5)
El elemento citado en segundo lugar se
escribe a la izquierda
Subíndice indicado por el prefijo (2)
Cuando el oxígeno se combine con los halógenos, los compuestos no se nombran como óxidos, sino como haluros (fluoruros, cloruros, bromuros, yoduros) de oxígeno (observar que el oxígeno se sitúa a la izquierda):
OCl2
El símbolo del elemento terminado en uro
se escribe a la derecha
Subíndice del cloro (2), indicado por el
prefijo
El oxígeno, citado en segundo lugar, se
escribe a la izquierda.
Subíndice indicado por el prefijo del
nombre que por ser mono-, no se pone.
Ejemplos:
|
Nombre |
Fórmula |
|
tetracloruro de carbono |
CCl4 |
|
hexafluoruro de azufre |
SF6 |
|
óxido de disodio |
Na2O |
|
disulfuro de plomo |
PbS2 |
|
dihidruro de calcio |
CaH2 |
|
cloruro de plata |
AgCl |
|
dióxido de carbono |
CO2 |
|
cloruro de hidrógeno |
HCl |
|
óxido de carbono, monóxido de carbono |
CO |
|
pentacloruro de fósforo |
PCl5 |
|
hidruro de potasio |
KH |
|
trióxido de difósforo |
P2O3 |
|
fluoruro de sodio |
NaF |
|
trihidruro de níquel |
NiH3 |
|
diyoduro de magnesio |
MgI2 |
|
sulfuro de dihidrógeno |
H2S |
|
bromuro de potasio |
KBr |
De
la fórmula al nombre
Para pasar de la fórmula al nombre hemos
de invertir el proceso seguido hasta ahora:
|
PbI2 diyoduro
de plomo
Prefijo multiplicador (di-) indicado por el subíndice que aparece en la
fórmula (2)
Prefijo multiplicador indicado por el
subíndice que aparece en la fórmula.
En este caso, al ser mono-, se suprime
Nombre del elemento escrito a la derecha terminado en -uro. Preposición “de” Nombre de elemento escrito a la izquierda
Elementos y terminación uro
H: hidruro
F: fluoruro
Cl: cloruro
Br: bromuro
I:
yoduro
S: sulfuro
N: nitruro
Ejemplo:
MgH2 dihidruro
de magnesio
Prefijo multiplicador (di-) indicado por el subíndice que aparece en la
fórmula (2)
Prefijo multiplicador indicado por el
subíndice que aparece en la fórmula. En este caso, al ser mono-, se suprime
Nombre del elemento escrito a la derecha
terminado en -uro. Preposición “de” Nombre de elemento escrito a la izquierda
IMPORTANTE
Las
combinaciones binarias del hidrógeno con los elementos de los grupos del C y
del N, pueden nombrarse como hidruros,
aunque están admitidos (y son muy usados) los nombres siguientes:
CH4 : metano
SiH4
: silano
NH3 : azano,
amoniaco
PH3
:
fosfano(1) No está permitido fosfina
AsH3
: arsano (2) No está permitido arsina
SbH3
: estibano (3) No está permitido estibina
Cuando sean compuestos con oxígeno, y este se encuentre escrito a la derecha, se nombran con la palabra óxido
Ejemplo:
CO2
dióxido de carbono
Prefijo multiplicador (di-) indicado por el subíndice que aparece en la
fórmula (2)
Prefijo multiplicador indicado por el
subíndice que aparece en la fórmula. En este caso, al ser mono-, se suprime
Palabra óxido. Preposición “de” Nombre de elemento escrito a la izquierda
Ejemplo:
P2O3 trióxido de difósforo
Prefijo multiplicador (tri-) indicado por el subíndice que aparece en la
fórmula (3)
Prefijo multiplicador (di-) indicado por el subíndice de la fórmula
(2).
Palabra óxido. Preposición “de” Nombre de elemento escrito a la izquierda
Importante H2O Puede nombrarse como agua (nombre vulgar
admitido). Según las normas IUPAC
también son correctos los nombres óxido de dihidrógeno y oxidano.
Ejemplos:
|
Fórmula |
Nombre |
|
Fe2O3 |
trióxido de dihierro |
|
NiH2 |
dihidruro de níquel |
|
Li2O |
óxido de dilitio |
|
SiCl4 |
tetracloruro de silicio |
|
NH3 |
trihidruro de nitrógeno, amoniaco |
|
PCl3 |
tricloruro de fósforo |
|
HF |
fluoruro de hidrógeno |
|
CoCl3 |
tricloruro de cobalto |
|
Cu2O |
óxido de dicobre |
|
PH3 |
trihidruro de fósforo, fosfano |
|
NaBr |
bromuro de sodio |
|
SO2 |
dióxido de azufre |
|
CaF2 |
difluoruro de calcio |
|
Ag2O |
óxido de diplata |
|
PbI |
yoduro de plomo |
|
CH4 |
tetrahidruro de carbono, metano |
|
Cr2O3 |
trióxido de dicromo |
Los compuestos
de los halógenos y los calcógenos (sin considerar el oxígeno) con el hidrógeno
son gases muy solubles en agua. Sus disoluciones tienen carácter ácido y se
nombran como tales.
HF(ac): ácido fluorhídrico
HCl(ac): ácido clorhídrico
HBr(ac): ácido bromhídrico
HI(ac): ácido yodhídrico
H2S(ac):
Ácido sulfhídrico
|
Nombrar |
Escribir
la fórmula |
|
Na2O |
Óxido de dilitio |
|
HCl |
Óxido de cinc |
|
AlH3 |
Tetracloruro de carbono |
|
AgCl |
Disulfuro de plomo |
|
SF6 |
Amoniaco |
|
Cu2O |
Dióxido de plomo |
|
SO3 |
Dihidruro de magnesio |
|
CH4 |
Disulfuro de carbono |
|
KI |
Cloruro de hidrógeno |
|
PCl5 |
Bromuro de potasio |
|
N2O5 |
Hidruro de potasio |
|
SO2 |
Tricloruro de hierro |
|
PH3 |
Fluoruro de hidrógeno |
|
Fe2S3 |
Dihidróxido de cobalto |
|
KOH |
Dicloruro de estaño |
|
P2O5 |
Trióxido de dioro |
|
CO |
Trihidróxido de hierro |
|
H2S |
Sulfuro de disodio |
|
Ca2C |
Tetracloruro de silicio |
|
NH3 |
Dicloruro de cobalto |
|
P2O3 |
Trióxido de dialuminio |
|
CO2 |
Dihidruro de cobre |
|
NaOH |
Fluoruro de hidrógeno |
|
NiI3 |
Disulfuro de carbono |
|
HI |
Óxido de calcio |
Cuestiones sobre formulación
Entra en joinmyquiz.com e introduce este
código 50169236 .
Enlace URL: https://quizizz.com/join?gc=50169236
Cuestiones sobre Hidruros
Entra en joinmyquiz.com e introduce este
código 57165204 .
Enlace URL: https://quizizz.com/join?gc=57165204
Cuestiones sobre formulación
binarios
Entra en joinmyquiz.com e introduce este
código 52626836 .
Enlace URL: https://quizizz.com/join?gc=
52626836
Cuestiones sobre formulación
química
Entra en joinmyquiz.com e introduce este
código 53020052.
Enlace URL: https://quizizz.com/join?gc=
53020052








No hay comentarios:
Publicar un comentario